Задания
ВНИМАНИЕ!
Задания 2 тура проекта для возрастных номинаций отличаются:
- 7-8 класс – онлайн-викторина, творческое задание;
- 9 класс – онлайн-викторина, творческое задание;
- 10 класс – онлайн-викторина, расчетная задача, творческое задание;
- 11 класс – онлайн-викторина, расчетная задача, творческое задание.
-
Онлайн-викторина
Ответы на вопросы викторины участники подают с помощью онлайн тестирования через Виртуальный кабинет. Для доступа к форме приема ответов используйте логин (игровой номер) и пароль, полученные при регистрации.
-
Расчетная задача – только для возрастных номинаций 10, 11 класс.
Результаты выполнения задания команды оформляют в одном файле (документ MicrosoftWord 97–2010 или OpenOffice.org Writer). Файл загружается через форму загрузки в Виртуальном кабинете (по ссылке «Расчетное задание»).
-
Творческое задание – общее для всех номинаций
Результаты выполнения творческого задания необходимо оформить в виде файлов:
- Электронныйтекстовый документ (документ MicrosoftWord 97–2010 или OpenOffice.org Writer) + Презентация (MicrosoftPowerPoint 97–2010 или OpenOffice.org Impress) – загружаются единым архивом через форму загрузки в Виртуальном кабинете (по ссылке «Творческое задание» – "Загрузить работу").
- по желанию можно подготовить видеофайл – загружается через форму загрузки в Виртуальном кабинете (по ссылке «Творческое задание» – "Видеосюжет") .
Все загружаемые файлы должны соответствовать техническим требованиям.
Окончание приема ответов на задания 2 тура – 18-00 (мск) 6 марта 2012 г.
Вопросы онлайн-викторины
Номинация 7-8 классы
Задание 1
Вещество, молекула которого состоит из четырех атомов, – это:
- сероводород
- тетрахлорид углерода
- аммиак
- вода
Задание 2
Сумма коэффициентов в уравнении, представленном схемой: Н2О + Р2О5 = Н4Р2О7
равна:
- 2
- 4
- 3
- 6
Задание 3
Химический процесс (в отличие от физических) – это:
- ржавление железа в воде
- плавление стали в конвертере
- плавление чугуна в домне
- сплавление железа с хромом
Задание 4
Массовая доля брома наибольшая в соединении:
- GaBr3
- AlBr3
- BBr3
- InBr3
Задание 5
Масса (в граммах) 0,2 моль гидроксида калия равна:
- 11,2
- 14,8
- 28
- 280
Задание 6
Количество вещества (моль) порции оксида натрия, содержащей 6,02·1023 атомов натрия, составит:
- 0,25
- 0,5
- 1
- 2
Задание 7
Число электронов на внешнем энергетическом уровне одинаково для:
- атомов хлора, марганца, брома
- атомов калия, кальция, скандия
- частиц S2-; Ar; Br-;
Задание 8
Укажите ряд элементов, которые в соединениях проявляют только степень окисления +1:
- Li, Na, H
- Li, Na, Cl
- Li, Rb, Cs
Задание 9
Максимальная степень окисления брома в соединениях равна:
- -1
- -7
- +3
- +7
- +5.
Задание 10
Два химических элемента имеют названия, в переводе с греческого означающие зеленый и фиолетовый. Назовите эти элементы.
Номинация 9 класс
Задание 1
Элементом, который проявляет в соединениях единственную степень окисления, является:
- водород
- кислород
- фтор
- медь
Задание 2
Молярная масса газа, 0,3 г которого занимает объем 0,224 л (н.у.), равна:
- 30 г/моль;
- 22,4 г/моль;
- 60 г/моль
Задание 3
Формулой оксида хрома, в состав которого входит 2,167 массовых частей хрома и 1,000 массовая часть кислорода, является:
- Cr2O3
- CrO
- CrO3
Задание 4
Массы водорода и кислорода, содержащихся в воде массой 1 кг, равны соответственно:
- 0,5 кг и 0,5 кг
- 0,11 кг и 0,89 кг
- 0,89 кг и 0,11 кг
- 0,34 кг и 0,66 кг
Задание 5
Объем хлороводорода (н.у.), который потребуется для приготовления 1 л водного раствора, в котором массовая доля хлороводорода равна 0,12 (или 12%), а плотность равна 1,059 г/см3, равен:
- 12 л
- 78 л
- 22,4 л
- 87 л
Задание 6
Чему равна степень окисления и валентность атома азота в молекуле азотной кислоты?
- степень окисления +5; валентность IV
- степень окисления +5; валентность V
- степень окисления +4; валентность V
Задание 7
Только восстановителем в химических реакциях является:
- водород
- кремний
- медь
- графит
Задание 8
При диссоциации 1 моля алюмокалиевых квасцов образуется катионов:
- 1 моль
- 2 моль
- 3 моль
- 4 моль
Задание 9
Сумма коэффициентов в уравнении окислительно-восстановительной реакции KClO3 + P → … равна:
- 18
- 15
- 21
- 19
Задание 10
Самым тугоплавким металлом является:
- вольфрам
- титан
- лантан
- цирконий
Номинация 10 класс
Задание 1
Формула высшего оксида элемента с электронной конфигурацией 1s22s22p63s23p2
- Э2О
- ЭО2
- ЭО3
- ЭО
Задание 2
Реакция среды нейтральная в растворе соли:
- Rb2S
- Rb2CO3
- Rb2SO3
- Rb2SO4
Задание 3
К 400 г 18%-го раствора гидроксида калия добавили 100 г раствора, содержащего 0,5 моль того же вещества. Конечная массовая доля растворенного вещества (в процентах) равна:
- 20
- 25
- 30
- 40
Задание 4
Диоксид серы реагирует с:
- CO2, O2
- KOH, KHCO3
- H2S, HCl
- H2SO4 (разб.); K2СO3
Задание 5
Смесь кальция и оксида кальция (массой каждого вещества по 15 г) обработали избытком разбавленной уксусной кислоты и собрали газ объемом … в литрах (н. у.).
- 2,1
- 4,2
- 8,4
- 16,8
Задание 6
В реакции серебряного зеркала 0,66 г альдегида образует 3,24 г осадка. Молекулярная формула альдегида:
- CH3CHO
- HCHO
- C2H5CHO
- C3H7CHO
Задание 7
В пробирке 1 находится бромная вода. В нее внесли палочку с прилипшими кристаллами неизвестного органического вещества. В пробирках с номерами 2-5 показаны происходящие изменения в течение нескольких секунд. Какие предположения о внесенном веществе (укажите его название) можно сделать, оценивая признаки проходящих реакций?

Задание 8
Для осуществления схемы превращений подберите необходимые реагенты, дайте название углеводороду Х1. Ответ состоит из цифр – номеров реагентов. приведенных в последовательности указанных превращений первых двух стадий и названия соединения Х1. Пример оформления ответа: 1,2 (толуол).
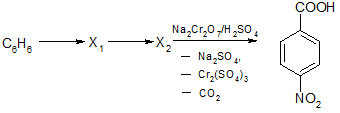
Реагенты:
- HNO3 + H2SO4
- CH3OH, H3PO4
- этилен, H3PO4
- пропен, H3PO4
Задание 9
Дайте названия веществам (A, B, D, C, E), участвующим в приведенной схеме превращений:
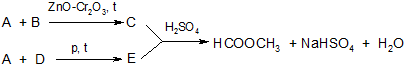
Задание 10
Назовите элемент, в атоме которого на предвнешнем уровне находится 13 электронов, а на четвертом внешнем – 2 электрона:
- технеций;
- железо;
- марганец;
- кобальт.
Номинация 11 класс
Задание 1
Плотность по водороду газовой смеси из 56 л аргона (н.у.) и 28 л азота (н.у.) равна:
- 16
- 18
- 19,5
- 22
Задание 2
Выберите ряд веществ, в котором энергия химической связи уменьшается, а длина связи возрастает:
- СН4; SiH4; GeH4
- H2S; H2O; SeH2
- HBr; HJ; HCl
- AsH3; NH3; PH3
Задание 3
Вещество в твердом агрегатном состоянии характеризуется низкой температурой плавления и кипения, высокой летучестью. Следовательно, кристаллическая решетка вещества:
- атомная
- ионная
- металлическая
- молекулярная
Задание 4
В ряду веществ: НF; HCl; HBr; HJ энергия межмолекулярных водородных связей:
- увеличивается
- уменьшается
- не изменяется
- увеличивается, а затем уменьшается.
Задание 5
Полярность химической связи наибольшая в частице:
- СО
- ВF3
- NF3
- NO
Задание 6
В пробирках 1 и 2 находятся водные растворы этилового спирта и фенола. В растворы опускают одинаковые стеклянные палочки с нанесенным на конец палочки неизвестным веществом.
Помешивая палочкой в растворах, наблюдают за происходящими внешними изменениями окраски растворов, которые можно заметить на этих стоп-кадрах (7 состояний).
Затем одну из пробирок помещают в пламя спиртовки и осторожно, при встряхивании раствора нагревают в течение минуты.
Какое вещество внесено в пробирки с растворами? В какой пробирке находится раствор этилового спирта, а в какой – раствор фенола (установите соответствие).

Задание 7
Навеску 26,8 г смеси двух одноосновных органических кислот растворили в воде. Половину раствора обработали избытком аммиачного раствора оксида серебра, при этом выделилось 21,6 г серебра. На нейтрализацию другой половины раствора потребовалось 0,2 моль гидроксида натрия. Определите: какие кислоты растворены в воде и какова масса каждой из кислот в смеси (в граммах). Ответом служат названия кислот и их масса, пример ответа: пропановая кислота (0,1 г); пентановая кислота (21.1 г)
Задание 8
При полном сгорании навески газообразного углеводорода, широко применяющегося в промышленном органическом синтезе, масса образовавшейся воды оказалась равной массе исходной навески. Определите строение углеводорода. Ответом служит название углеводорода (IUPAC).
Задание 9
При нитровании бензола получен продукт, для полного восстановления 2,07 г которого необходим раствор 14,4 г нонагидрата сульфида натрия (в ходе восстановления выпадает желтоватый осадок). Определите вероятный качественный и количественный состав продукта нитрования. Условия реакции нитрования не приводятся.
Задание 10
Установите структурную формулу соединения С6Н12Cl2, если при гидролизе оно переходит в карбонильное соединение, а при окислении последнего образуется смесь ацетона, уксусной, пропионовой и 2-метилпропионовой кислот. Ответом служит название вещества (IUPAC) .
Расчетная задача – только для возрастных номинаций 10, 11 класс
Номинация 10 класс
Расчетная задача:
Сколько граммов декагидрата сульфата натрия (Na2SO4·10H2O) выделится из 100 г насыщенного при 30°С раствора, который охлажден до 0°С? (Примечание: массовая доля безводного сульфата натрия при 0°С равна 4,3 %; а при 30°С – 29 %).
Дать подробное решение задачи.
Номинация 11 класс
Расчетная задача:
Сколько граммов воды и медного купороса нужно взять для приготовления такого количества насыщенного при 80°С раствора, который при охлаждении до 0°С выделит 20 г медного купороса? (Массовая доля безводного сульфата меди при 80°С составляет 34,9%; а при 0°С – 12,9%).
Дать подробное решение задачи.
Творческое задание – общее для всех номинаций
Однажды в детском саду ребятишкам дали возможность «похимичить» (см. видеофрагмент; для просмотра видео на компьютере должен быть установлен Adobe Flash Player).
Порядок выполнения творческого задания
- Понаблюдайте за действиями ребят в видеофрагменте.
- Опишите, что они делают.
- Придумайте и запишите свою сказку (в прозе или стихотворной форме) на химическую тему для детей младшего возраста. Место действия – кухня. В сказке должны соблюдаться все правила безопасного обращения с химическими веществами. Примечание: В качестве «химических реактивов» используйте имеющиеся на кухне: соль, сахар, пищевая сода, уксус (разбавленный), лимонная кислота, мука, крахмал, мыло, жидкое моющее средство для посуды, а также любые фрукты и овощи, чай каркаде, сушеные растения или замороженные ягоды. При использовании других веществ, дайте обоснование возможности их использования.
- Команды возрастных номинаций 9, 10, 11 классы должны привести уравнения реакций тех превращений, которые будете наблюдать в рамках учебной программы курса химии соответствующего класса.
- Оформите сказку в мультимедиа формате.
Оформление творческой работы
Результат выполнения творческого задания – два файла:
-
Текстовый документ включает в себя: пример оформления документа
- описание видеофрагмента (пункт 2 творческого задания);
- текст своей сказки;
- перечень используемых «химических реактивов» с описанием их свойств, которые должны наблюдаться;
- уравнения реакций (возможных) – для 9-11 классов.
-
Иллюстрации – в любом из следующих мультимедиа форматов:
- Презентация MicrosoftPowerPoint 97–2010 или OpenOffice.org Impress (файлы *.ppt, *.pps, *.pptx, *.ppsx, *.odp). На слайдах могут быть текстовые пояснения.
- Видеофайл.
Примечание: в работе не должны быть использованы материалы (рисунки, фотографии), взятые из сети Интернет. В своих работах можно использовать только собственные фотографии, рисунки, модели, которые вы создадите.
Критерии оценивания творческих работ:
- Грамотное описание видеофрагмента с химической точки зрения.
- Содержание сказки: занимательность, соблюдение правил безопасного использования веществ.
- Качество оформления: общее впечатление от оформления, его соответствие содержанию сказки.
- Химическая грамотность постановки сказки.
Возникли вопросы?
- Электронная почта (e-mail): chemproject@edu.yar.ru
- Телефон: +7 (4852) 32-88-91, 30-29-62
- Конференц-связь MS Lync: aliya@unicom.edu.yar.ru (для участников из Ярославской области)